Le modèle de l’atome – Cours et exercices Tronc commun
Le modèle de l’atome – Cours Chimie Tc Biof Ce cours de chimie présente le modèle de l’atome, sa structure interne, la composition du noyau et les notions essentielles liées à l’élément chimique. Il s’adresse aux élèves du Tronc Commun …
Le modèle de l’atome – Cours Chimie Tc Biof
Ce cours de chimie présente le modèle de l’atome, sa structure interne, la composition du noyau et
les notions essentielles liées à l’élément chimique.
Il s’adresse aux élèves du Tronc Commun Scientifique international pour comprendre la constitution et les propriétés des atomes.
I. Structure de l’atome (Tc)
1. Constituants de l’atome
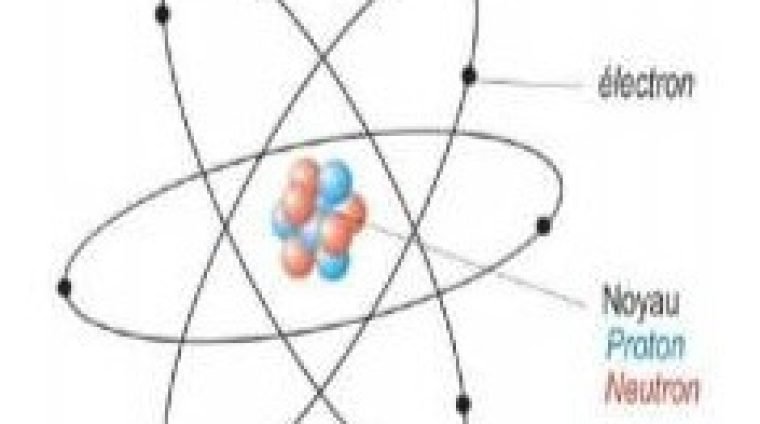
L’atome est constitué d’un noyau central autour duquel gravitent des électrons.
Le noyau contient des particules appelées nucléons, divisées en deux catégories :
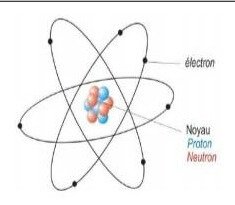
- Le proton (p) : particule de charge positive q = +1,6×10⁻¹⁹ C et de masse mₚ ≈ 1,673×10⁻²⁷ kg.
- Le neutron (n) : particule neutre (charge nulle) de masse mₙ ≈ 1,675×10⁻²⁷ kg.
- L’électron (e⁻) : particule très légère, de masse mₑ ≈ 9,11×10⁻³¹ kg et de charge négative q = −1,6×10⁻¹⁹ C.
2. Notation symbolique
Un atome est représenté par le symbole suivant :
ᵃZ X
- X : symbole de l’élément chimique.
- A : nombre de masse (nombre total de nucléons).
- Z : numéro atomique (nombre de protons).
- N = A – Z : nombre de neutrons.
3. Neutralité électrique de l’atome
Un atome neutre contient autant de protons que d’électrons, d’où :
Qtotal = Qnoyau + Qélectrons = 0
⇒ Nombre d’électrons = Z
La charge totale de l’atome est donc nulle.
II. La masse et les dimensions de l’atome
1. Masse de l’atome
La masse d’un atome correspond à la somme des masses de ses constituants :
matome = Z·mₚ + (A – Z)·mₙ + Z·mₑ
Comme la masse des électrons est négligeable, on peut approximer :
matome ≈ A·mₚ
2. Dimensions de l’atome
L’atome a un rayon de l’ordre de 10⁻¹⁰ m alors que son noyau a un rayon de l’ordre de 10⁻¹⁵ m.
Le volume de l’atome est donc environ 100 000 fois plus grand que celui de son noyau,
ce qui montre que l’atome est principalement constitué de vide.
III. L’élément chimique
1. Définition
Un élément chimique est l’ensemble des atomes possédant le même numéro atomique Z.
Chaque élément est représenté par un symbole chimique (H, O, C, Na…).
2. Exemples
| Nom | Symbole | Numéro atomique Z |
|---|---|---|
| Hydrogène | H | 1 |
| Carbone | C | 6 |
| Azote | N | 7 |
| Oxygène | O | 8 |
| Fer | Fe | 26 |
| Zinc | Zn | 30 |
3. Les isotopes
Les isotopes d’un élément ont le même numéro atomique Z mais un nombre de masse A différent.
Exemple : pour le carbone → 12C, 13C, 14C.
4. Les ions monoatomiques
Un ion monoatomique résulte de la perte ou du gain d’un ou plusieurs électrons :
- Si un atome perd des électrons → il devient un cation (charge positive).
Exemples : Na⁺, Mg²⁺, Al³⁺ - Si un atome gagne des électrons → il devient un anion (charge négative).
Exemples : F⁻, Cl⁻, O²⁻
5. Conservation de l’élément chimique
Lors d’une réaction chimique, le nombre d’atomes de chaque élément se conserve :
les éléments chimiques ne sont ni créés ni détruits, ils se combinent différemment pour former de nouvelles molécules.
Mots-clés de cette chapitre:
modèle de l’atome, structure de l’atome, noyau, proton, neutron, électron,
masse atomique, isotopes, ion monoatomique, élément chimique,
chimie tronc commun, physique chimie Maroc.
You might be intersted in
-
0 Etudiant
-
10 Weeks
-
0 Etudiant
-
10 Weeks
-
0 Etudiant
-
10 Weeks
-
0 Etudiant
-
10 Weeks