La géométrie de quelques molécules et la notion d’isomérie – Chimie Tronc Commun
Ce cours de chimie porte sur la géométrie des molécules, la notion d’isomérie,
les différents types de formules (brute, semi-développée, développée) ainsi que la
représentation de Lewis et la représentation de Cram. Il s’adresse aux élèves du
Tronc Commun .
1) Types de formules d’une molécule Tronc commun
Une même molécule peut être représentée par plusieurs types de formules chimiques, chacune donnant un niveau
d’information différent sur la structure de la molécule.
| Type de formule | Définition | Exemple |
|---|---|---|
| Formule brute | Indique le nombre et la nature des atomes présents dans la molécule. | C4H9N |
| Formule semi-développée | Précise le type de liaisons entre les atomes principaux, sans montrer tous les doublets. | CH3–CH2–CH2–NH2 |
| Formule développée | Issue du modèle de Lewis, elle montre toutes les liaisons covalentes et peut faire apparaître les doublets non liants. |
Représentation détaillée de C4H9N avec toutes les liaisons. |
2) Notion d’isomérie
On appelle isomères toutes espèces chimiques ayant la même formule brute mais des
formules semi-développées différentes. Ces molécules peuvent présenter des propriétés physiques
ou chimiques différentes.
Exemple d’isomérie
| Formule brute | Formules semi-développées possibles |
|---|---|
| C2H7N | CH3–CH2–NH2 CH3–NH–CH3 |
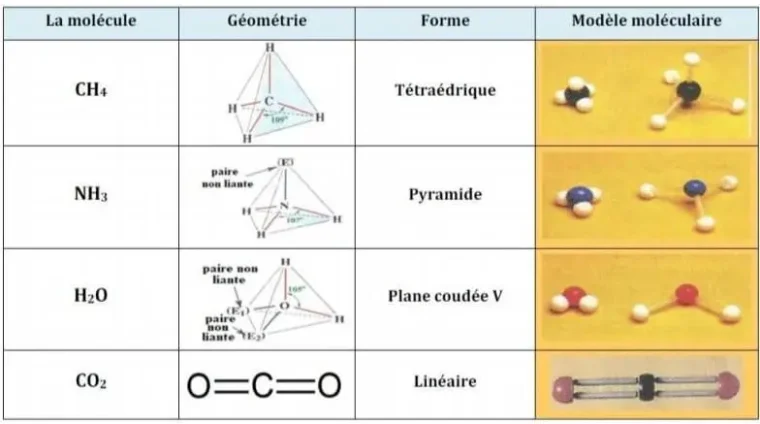
3) Géométrie spatiale de quelques molécules TC Biof
La géométrie d’une molécule dépend de la répulsion entre les doublets liants et non liants.
Les doublets électroniques se repoussent et cherchent à occuper la position la plus éloignée possible les uns
des autres. On en déduit la forme spatiale de la molécule (théorie VSEPR).
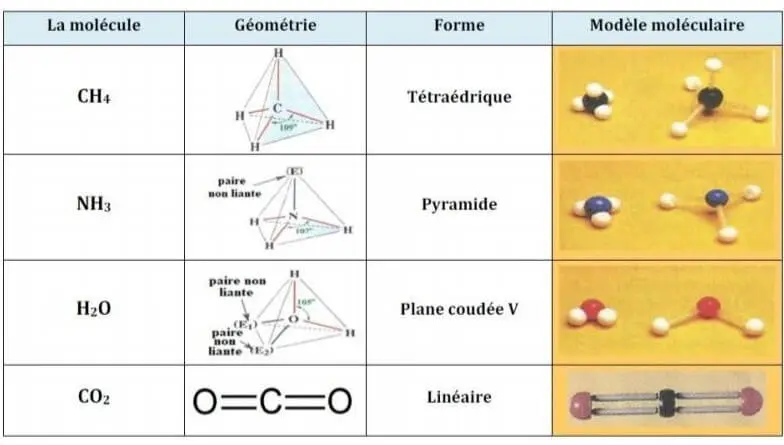
| Molécule | Géométrie | Forme | Remarques |
|---|---|---|---|
| CH4 | Tétraédrique | Tétraédrique | Pas de doublets non liants sur le carbone. |
| NH3 | Pyramide à base triangulaire | Pyramide | Un doublet non liant sur l’atome d’azote. |
| H2O | Plane coudée | Forme en V | Deux doublets non liants sur l’oxygène. |
| CO2 | Linéaire | Linéaire | Deux liaisons doubles C=O et pas de doublet non liant sur le carbone. |
4) Représentation de Cram
La représentation de Cram offre une vision en perspective de la molécule, permettant de
visualiser la disposition spatiale des atomes :
- Liaison dans le plan de la feuille : trait simple.
- Liaison en avant du plan : triangle plein.
- Liaison en arrière du plan : trait hachuré.
On l’utilise par exemple pour représenter la géométrie de molécules comme NH3, CH4 ou C2H6.
5) Règles de Duet et de l’Octet
a) Stabilité des gaz rares
Les gaz rares (ou gaz nobles) possèdent des couches électroniques externes saturées, ce qui les
rend chimiquement stables. Ils ne participent presque pas aux réactions chimiques.
b) Règle du Duet
Les éléments légers (Z ≤ 4) tendent à acquérir la structure électronique de l’hélium (K2), c’est-à-dire
2 électrons sur la couche externe.
c) Règle de l’Octet
Les autres éléments cherchent, lors des transformations chimiques, à avoir 8 électrons sur la couche externe,
comme les gaz rares de la deuxième période (Ne, Ar…). Ils gagnent, perdent ou partagent des électrons afin de
stabiliser leur configuration.
6) Liaison covalente et représentation de Lewis
a) Liaison covalente
Une liaison covalente est une liaison chimique dans laquelle deux atomes partagent un ou plusieurs
doublets d’électrons :
- Liaison covalente simple : H–H
- Liaison covalente double : O=O
- Liaison covalente triple : N≡N
b) Représentation de Lewis d’une molécule
La représentation de Lewis montre les atomes, les doublets liants (liaisons) et les
doublets non liants autour de chaque atome.
Étapes générales :
- Écrire la structure électronique de chaque atome.
- Déterminer le nombre total d’électrons de valence.
- Placer les liaisons entre les atomes (doublets liants).
- Compléter avec les doublets non liants pour satisfaire la règle du duet ou de l’octet.
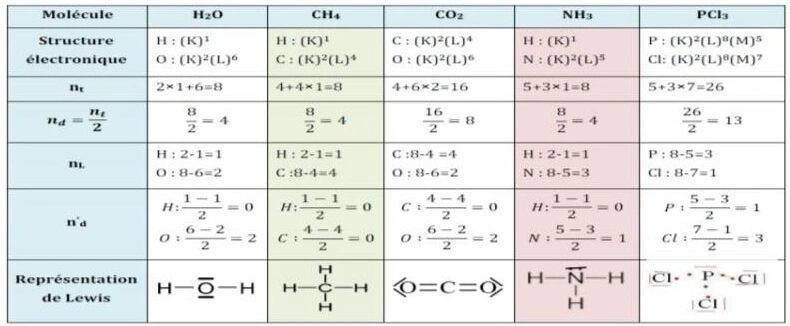
Exemples de quelques molécules TC avec exercices
| Molécule | Structure électronique externe (simplifiée) | Doublets liants | Doublets non liants | Représentation de Lewis (schéma) |
|---|---|---|---|---|
| H2O | O : 6 e– de valence, H : 1 e– | 2 | 2 sur O | H–O–H avec deux doublets libres sur O |
| CO2 | C : 4 e–, O : 6 e– | 4 (deux liaisons doubles C=O) | 4 doublets non liants (deux sur chaque O) | O=C=O |
| NH3 | N : 5 e–, H : 1 e– | 3 | 1 doublet non liant sur N | Structure pyramidale avec N au sommet |
7) Conclusion
La géométrie des molécules et la notion d’isomérie jouent un rôle central en chimie. Elles permettent
d’expliquer les propriétés physiques (état, solubilité, polarité) et chimiques (réactivité, stabilité) des
substances. La maîtrise des formules chimiques, de la géométrie moléculaire et du
modèle de Lewis est indispensable pour réussir en chimie au Tronc Commun et en 1ère Bac.